
Валидация аналитических методик: особенности и перевод документации
Валидация аналитических методик — это гарантия того, что контроль качества фармацевтической продукции является надежным. Ее проведение обязательно для:
- регистрации лекарственного препарата,
- запуска производства лекарственного средства на новой площадке,
- выпуска препарата для пациентов.
В данной статье представлен упрощенный обзор общих теоретических и нормативно-правовых аспектов этой процедуры.
Суть валидации
Валидация — это тщательно задокументированная проверка на предмет надежности и применимости по оговоренному назначению. В случае аналитической методики — это применение валидируемой процедуры для анализа образца, характеристики которого однозначно известны.
Если методика валидирована, то:
- она позволяет отличить конкретный аналит (анализируемое вещество) от любого другого соединения;
- результат анализа не зависит от индивидуальных (не прописанных в методике) особенностей аналитика или лаборатории.
Обязательное условие валидации аналитической методики — использование надлежащих стандартных образцов.
Виды аналитических методик
Валидировать необходимо каждую методику, которая упоминается в спецификациях на выпуск и срок годности лекарственного средства. Однако объем прилагаемых для этого усилий может существенно варьироваться: от указания ссылки на общепринятую версию методики до многостраничного полноценного всестороннего экспертного анализа.
В целом международные нормы позволяют выделить 2 категории аналитических методик:
- фармакопейные;
- нефармакопейные.
Фармакопея — это сборник минимальных требований к качеству лекарственного средства на определенной административной территории. Как следствие, критерии отнесения методик в разных странах имеют региональные особенности и задаются местными уполномоченными органами, хотя в целом схожи. Ниже обобщены нормы Евразийского экономического союза (ЕАЭС):
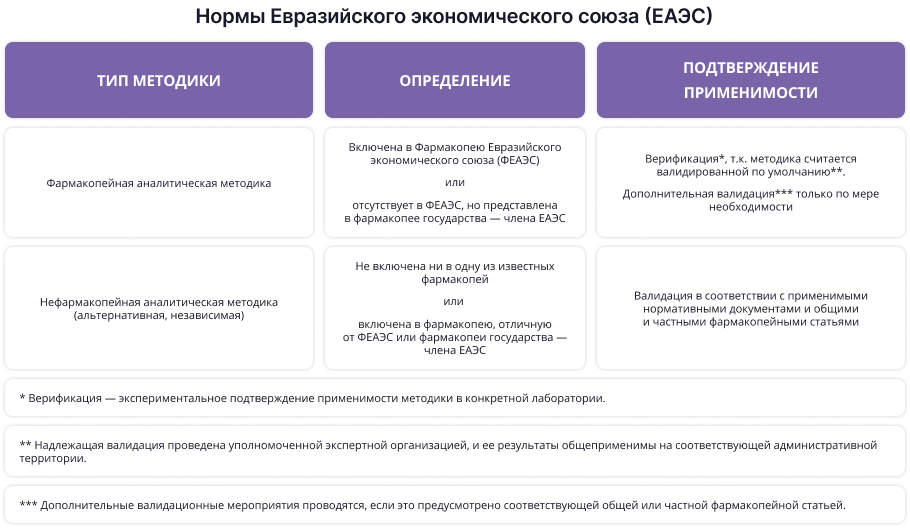
Таким образом, использование фармакопейных методик позволяет минимизировать усилия для валидации. При этом важно помнить, что интерпретировать понятие «фармакопейная» следует осторожно, с учетом страны происхождения соответствующего информационного материала. В частности, этот термин в оригинальном и переводном тексте содержит отсылки к разным требованиям и условиям: в тексте, подготовленном на территории ЕАЭС, — на ФЕАЭС, в Европейском Союзе — на Фармакопею Европейского Союза и т.п.
Документы, регламентирующие валидацию аналитических методик в ЕАЭС, ЕС, США, Китае, Индии и Японии
На данный момент валидация аналитических методик в разных странах и союзах регламентируется разными документами. В них прописаны:
- терминология;
- валидационные характеристики аналитических методик в зависимости от цели анализа;
- общий алгоритм валидационных мероприятий.
Союзные документы приоритетнее национальных.
Валидацию аналитических методик в ЕАЭС регламентируют:
- Фармакопея Евразийского экономического союза. Глава 1.1 «Общие положения» (101000000-2019);
- Фармакопея Евразийского экономического союза. ОФС 2.3.15.0 «Верификация фармакопейных методик» (203150000-2022);
- Фармакопея Евразийского экономического союза. ОФС 2.3.14.0 «Валидация аналитических методик» (203140000-2022);
- применимые статьи национальных фармакопей;
- Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 (ред. от 24.11.2023) «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения»;
- Рекомендация Коллегии ЕЭК от 27 декабря 2022 № 49 (ред. от 27 июня 2023) «О Руководстве по составлению документации по химическому и фармацевтическому качеству для исследуемых лекарственных средств, применяемых в клинических исследованиях»;
- Решение Коллегии ЕЭК от 7 сентября 2018 г. № 151 (в редакции Решения Коллегии Евразийской экономической комиссии от 4 октября 2022 г. № 137) «Об утверждении Руководства по составлению нормативного документа по качеству лекарственного препарата»;
- Руководство Фармакопейного комитета Евразийского экономического союза от 19 сентября 2019 «Руководство по разработке частных фармакопейных статей Фармакопеи Евразийского экономического союза»;
- Решение Коллегии ЕЭК от 17 июля 2018 № 113 «Об утверждении Руководства по валидации аналитических методик проведения испытаний лекарственных средств».
Основное международное руководство по валидации аналитических методик:
- ICH Q2(R2) Validation of analytical procedures — Scientific guideline (EMA/CHMP/ICH/804363/2022, 14.06.2024).
Валидацию аналитических методик в странах Европейского союза определяют:
- применимые статьи Европейской фармакопеи (European Pharmacopoeia (Ph. Eur.));
- применимые статьи национальных фармакопей.
Валидация аналитических методик в США должна соответствовать:
- Применимым статьям национальной фармакопеи (United States Pharmacopeia – National Formulary (USP–NF));
- U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER). M10 BIOANALYTICAL METHOD VALIDATION AND STUDY SAMPLE ANALYSIS (FDA-2019-D-1469; 04.11.2022);
- U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Veterinary Medicine (CVM). Bioanalytical Method Validation (FDA-2013-D-1020; 22.05.2018);
- U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER). Analytical Procedures and Methods Validation for Drugs and Biologics (FDA-2015-N-0007; 27.07.2015).
В Китае, Индии и Японии доступны соответствующие статьи национальных фармакопей.
Приведенный список не претендует на звание исчерпывающего. Фармацевтическая отрасль тяготеет к гармонизации, унификации и взаимопризнанию. Как следствие, возможно, что в ближайшем будущем появятся или конкретизируются международные, союзные или взаимно признаваемые регламенты. Кроме того, постепенно разрабатываются, внедряются и разъясняются требования к валидации новейших аналитических методик (например, в сфере биотехнологий).
Кто проводит валидацию аналитических методик?
Валидацию нефармакопейных аналитических методик проводит ответственное подразделение компании (как правило, отдел обеспечения качества). Для этого привлекаются специалисты с надлежащим набором навыков, квалификации и опыта работы. Разработка программы валидации требует углубленных знаний и навыков в области валидируемой методики, поэтому на данном этапе возможно привлечение стороннего эксперта.
Документы, необходимые для валидации аналитической методики
Порядок валидации аналитических методик определяется внутренней документацией:
- протоколом;
- стандартной операционными процедурами;
- рабочими инструкциями и т.п.
Документы, составляемые в рамках валидации аналитической методики
По итогам валидации:
- формируется первичная документация (лабораторные журналы, распечатки с анализаторов и т.п.),
- составляется отчет,
- прилагаются копии сертификатов на использованные стандартные образцы и свидетельств о калибровке оборудования.
Рекомендуется представлять материалы валидации всех аналитических методик в форме объединенного отчета о валидации.
Перевод документов по валидации аналитических методик в бюро переводов ТРАКТАТ
Мы удовлетворяем запросы на перевод документов по валидации аналитических методик в разных языковых парах уже более 15 лет:
- привлекаем переводчиков, которые имеют как минимум теоретическую подготовку по принципам валидируемой методики, т.е. в области хроматографии, масс-спектрометрии, микробиологии, генетики, молекулярной биологии и т.д.;
- следим за правильностью сопоставления терминов стран создания оригинального документа и применения перевода;;
- обеспечиваем качественную подготовку исходных файлов к переводу (сканирование с усилением контрастности, восстановление выцветших фрагментов и т.п.).;
Выполнение этих условий упрощает и ускоряет внедрение валидированных аналитических методик в практику и комплектацию регистрационного досье лекарственного препарата на основе переводной документации. Подробнее об услуге письменного перевода вы можете ознакомиться в соответствующем разделе нашего сайта.
